
Förespråkande
Fokuserar på behoven hos de sista 10%
Att förespråka och företräda de sista 10% i CF-samfundet är en viktig del av EE:s uppdrag. EE hade under årens lopp fått ett välförtjänt rykte om sig att vara en effektiv förespråkare för forskning och utveckling av behandlingar för dem som tillhör de sista 10% i CF-samfundet, men det fanns en växande insikt om EE:s unika värde på det regulatoriska området - och särskilt i förhållande till viktiga tillsynsmyndigheter som Food & Drug Administration (FDA).
År 2021 förde EE sin talan till FDA genom att värd för en FDA Patient Listening Session. Detta var ett stort steg för organisationen. EE:s sätt att arbeta med intressebevakning har alltid placerat patienten i förarsätet och arbetat sida vid sida med forskarvärlden. Samarbetet med FDA om en session som specifikt fokuserade på de ouppfyllda behoven hos de sista 10% i CF-gruppen återspeglade EE:s inflytelserika, växande röst inom flera områden som är av största vikt för terapeutisk utveckling, inklusive det regulatoriska området.

FDA:s patientlyssningssessioner är små, informella möten som är stängda för allmänheten och där patientorganisationer talar med FDA:s personal om sina erfarenheter av att leva med och hantera en sjukdom. Målen för EE:s lyssnarmöte var att dela med sig av och förmänskliga de akuta, icke tillgodosedda terapeutiska behov som kvarstår för CF-samfundets sista 10%; bygga upp en stark relation med FDA för att uppmuntra prioritering och påskyndade regulatoriska granskningar och godkännanden i framtiden; och säkerställa att CF-samfundets perspektiv inkluderas i varje steg av läkemedelsutvecklingen och godkännandeprocesserna.
Vid mötet informerade EE FDA:s personal om EE, CF och de återstående 10% av CF-gruppen som inte har nytta av de CFTR-modulatorer som finns tillgängliga idag, inklusive de med CF-nonsensmutationer. Evenemanget innehöll kommentarer från en läkare samt sex CF-medlemmar, däribland personer med CF, föräldrar och syskon till personer med CF samt en förälder till en avliden person med CF, som delade med sig av sina erfarenheter av sjukdomen. Dessa djupt personliga och innerliga berättelser bidrog till att förmedla till FDA hur angeläget det är att hitta behandlingar för de återstående 10% i CF-gruppen.
Berättelser som lyftes fram under FDA:s lyssningssessioner:
Som en del av FDA:s lyssnarsession fick deltagarna lyssna till sex medlemmar av CF-communityn, däribland Abhijit Tirumala, en 19-årig universitetsstudent med cystisk fibros. Som en del av sitt vittnesmål berättade Abhijit om hur CF påverkar hans psykiska hälsa och hur hans liv skulle förändras om ett nytt läkemedel kunde minska hans beroende av dagliga behandlingar och mediciner.

I juni 2021 genomförde EE sin första omfattande, globala undersökning av de cirka 10% individer i CF-communityn som inte har nytta av de CFTR-modulatorer som för närvarande finns tillgängliga på grund av olämpliga mutationer, biverkningar eller bristande tillgång. Syftet med undersökningen "Final 10%" var att samla in information om hälsostatus, påverkan av CF, ouppfyllda behandlingsbehov och preferenser för klinisk forskning hos dem som inte drar nytta av CFTR-modulatorer samt att presentera preliminära data och resultat vid FDA:s "Listening Session".
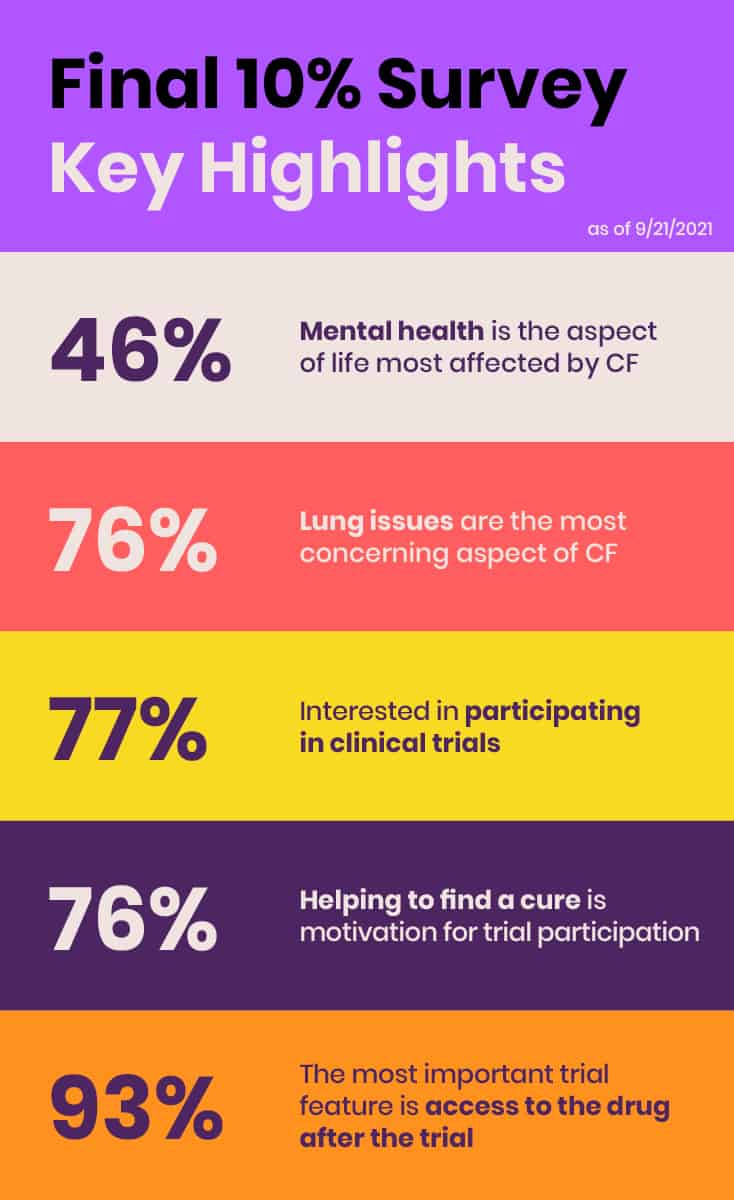
Undersökningen är ett annat exempel på hur EE identifierar behov och fyller kritiska luckor. Även om enkäten ursprungligen var avsedd att komplettera de sex CF-medlemmarnas berättelser vid FDA:s lyssningssession med grundläggande kvantitativa data, stod det snabbt klart att dess värde var mycket större och mer omfattande. Undersökningen gav ett robust svar, med 431 respondenter från 29 länder på fem kontinenter. EE planerade att publicera resultaten i en vetenskapligt granskad tidskrift för att säkerställa att dessa data är fullt tillgängliga för allmänheten.



